-
수산화칼슘, 탄산칼슘, 탄화칼슘, 탄화칼슘과 반응정리일반기술, 자연과학, 세라믹 2023. 3. 18. 08:08728x90
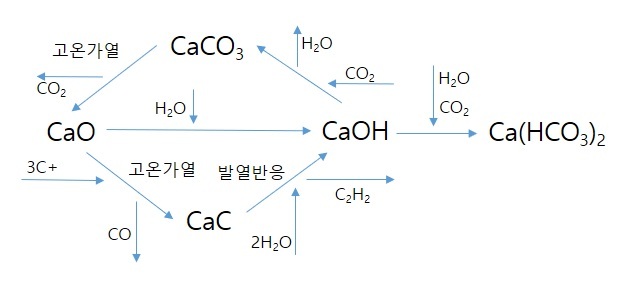
주요반응 요약
탄산칼슘
탄산 칼슘(Calcium carbonate, CaCO3)은 탄산이온과 칼슘이온이 만나 생성되는 흰색 물질로 탄산 석회라고도 한다. 물에 잘 녹지 않고 침전된다. 석회암 동굴의 종유석, 석순, 석주 등을 이루는 물질이며, 예전에 분필에 많이 사용되었다. 지구상에 존재하는 대부분의 이산화 탄소(CO2)는 탄산 칼슘의 형태로 존재한다. 탄산 칼슘을 섭씨 900도 이상의 고온에서 가열하면 이산화 탄소가 빠져 나가면서 산화 칼슘(CaO)이 생성된다. 산에는 쉽게 반응하여 이산화 탄소를 발생하며 녹는다
수산화칼슘
수산화 칼슘(영어: Calcium hydroxide, Ca(OH)2은 소석회, 가성석회라고 불리기도 한다. 수산화기를 포함하고 있기 때문에 수용액 상에서 염기성을 띤다. 물에 잘 녹지는 않지만 이온화도(해리성)가 높은 특성이 있기 때문에 물에 녹은 수산화칼슘은 강한 염기성을 나타낸다. 강한 염기성을 이용하여 소석회. 즉, 수산화 칼슘이 들어간 비료를 사용하여 산성화 된 토양을 중화시키는데 사용되기도 한다.
수산화칼슘의 주요반응
가수분해 : 탄화 칼슘(CaC2)를 가수분해시키면 아세틸렌(C2H2)과 수산화 칼슘(Ca(OH)2)이 생성된다.
CaC2 + 2 H2O → C2H2 + Ca(OH)2 + 33.07kcal/mole
용해 : 산화 칼슘(CaO)을 물과 반응시키면 물 분자 하나(H2O)와 반응하여 수산화 칼슘(Ca(OH)2)이 생성
CaO + H2O → Ca(OH)2
이산화탄소와 반응
① Ca(OH)2 + CO2 → CaCO3 + H2O
② CaCO3 + H2O + CO2 → Ca(HCO3)2
산화칼슘
산화 칼슘(Calcium oxide, CaO)은 칼슘의 산화물로 생석회, 생회(生灰), 강회(剛灰), 백회(白灰)라고도 불린다. 일반적으로 탄산 칼슘(CaCO3)을 높은 온도로 가열하면 이산화탄소(CO2)를 잃으며 생성된다.
CaCO3(s) → CaO(s) + CO2(g)
생석회(산화칼슘)이 물에 용해되면 물과 반응하여 수산화 칼슘(Ca(OH)2)이 생성되면서 이온화되어 용액이 염기성을 띤다.
CaO(s) + H2O(l) → Ca(OH)2(s)
이와 같은 성질 때문에 산성비와 화학 비료 등으로 산성화 된 논이나 밭을 중화시키는 데 많이 이용되었다. 그러나, 중화 과정에서의 중화열의 양 및 물에 용해되는 과정에서의 용해열의 양이 비교적 크기 때문에 보관 시 밀폐하여 공기 중의 수분과의 접촉을 피해야 하며, 이온화도가 상당히 크기 때문에 수용액과의 직접적인 접촉을 피해야 한다. 이와 같은 반응성 때문에, 불이 일어날 수 있으며, 피부 조직에 화상을 입을 수 있다.
탄화 칼슘
탄화 칼슘(Calcium carbide, CaC2)은 칼슘 카바이드(calcium carbide), 줄여서 카바이드(carbide)라고도 불린다. 두 개의 탄소 원자가 삼중 공유 결합을 한 2- 음이온과, 2+ 전하를 띠는 칼슘 양이온이 이온 결합한 물질이다.
'일반기술, 자연과학, 세라믹' 카테고리의 다른 글
글라스울(glass wool) (0) 2023.07.08 튜빙(Tubing), 피팅(Fitting), 너트(Nut), 패럴(Ferrule) 관련 규격 (가스배관 실무) (0) 2023.04.29 색온도와 연색성 (0) 2023.03.14 NFPA 심볼, GHS마크 (1) 2023.03.11 공기청정기에 사용되는 필터의 종류 (0) 2023.03.10