-
알루미나(Alumina, Aluminium Oxide)일반기술, 자연과학, 세라믹 2023. 3. 6. 12:47728x90
개요
화학식 Al2O3, 분자량은 101.96로서, 알루미늄과 산소의 화합물로써 공업적으로는 알루미나(Alumina)라고도 한다. 천연으로는 결정광물인 코런덤(corundum)으로 산출되고, 또 순수한 코런덤이 착색된 루비(Fe, Ti, Cr 등에 의한 착색) 와 사파이어(Mg 등에 의한 착색)도 있다. α, β, γ-Al2O3 등이 존재한다. 높은 경도와 용융열로 인해 연마제, 혹은 내화재로 사용된다.
제법
제법은 공업적인 원료광물은 산화알루미늄 수화물인 보크사이트(깁사이트(gibbsite), Al2O3·3H2O, 베마이트(boehmite), Al2O3·2H2O를 주성분으로 하는 것)나 반토혈암(다이아스포어 Al2O3·H2O를 주성분으로 하는 것)또는 규산염광물인 점토·백반석 등이 있다. 제조법은 산법과 알칼리법으로 대별되는데, 산법에서는 원료를 산에 녹여 분별결정법에 의하여 알루미늄염으로 만들어 암모니아로 수산화알루미늄으로 바꾼 다음, 소성하여 산화알루미늄으로 만드는데, 이것은 소규모의 것이 많다.
현재 가장 널리 대규모로 사용되는 것은 알칼리법 중 베이어(Bayer)법이다. 이것은 먼저 보크사이트를 배소·분쇄하여 가압솥 속에서 진한 수산화나트륨 용액과 가열하면 알루민산나트륨(NaAlO2)로서 용액 속에 추출된다. 광석 속의 불순물(주로 산화철·규산염·산화티탄 등)은 침전물로서 제거된다. 다음에 이 여과액을 물로 희석하고, 깁사이트를 가하여 휘저으면 결정이 석출한다. 이것을 여과하여 물로 씻은 다음, 건조시킨 것이 수산화알루미늄의 공업제품이다. 이것을 다시 1,200 ℃ 이상에서 소성하여 α-산화알루미늄의 형태로 만든 것이 산화알루미늄의 공업제품이다.
특성
α-알루미나는 알루미늄의 주된 제조원료이며, 일반적으로 융해하여 석출시킨 결정은 굳기가 단단하고(모스굳기 9), 굴절률 1.76∼1.77이며, 인조보석·연마제로서도 사용된다. 결정도가 높은 α-알루미나는 산이나 알칼리에 잘 녹지 않으므로, 소결하여 알루미나 자기를 만드는데 사용한다. 산화알루미늄 중 결정성이 나쁜 것은 탈수촉매로서의 작용이 강하여 촉매로 사용된다. 결정화하지 않은 산화알루미늄 또는 산화알루미늄수화물을 일반적으로 알루미나겔이라고 하는데 이것은 제산제·흡착제로 사용된다.
Al2O3는 전기 절연체지만 세라믹 소재의 경우 열전도도가 상대적으로 높다(30Wm-1K-1)] 산화 알루미늄은 물에 녹지 않는다. 코룬덤 또는 α-알루미나는 가장 일반적인는 결정형으로 경도가 높아 연마재로 사용하기에 적합하다. 산화알루미늄은 산화에 대한 저항성이 높아 금속 알루미늄의 산화를 방지하는 피막으로 사용된다. 금속 알루미늄은 대기 산소와 반응성이 매우 높으며 노출된 알루미늄 표면에 얇은 산화 알루미늄(4 nm 두께)의 침투층이 형성된다. 이 층은 금속을의 산화(녹슴)로부터 보호하는 역할을 한다. 이 산화층의 두께와 특성은 양극화라고 불리는 과정을 통해 강화될 수 있다. 양극화에 의해 생성된 산화알루미늄은 전형적으로 비결정적이지만, 플라즈마 전기 산화와 같은 방전 보조 산화 과정은 코팅에서 결정알루미늄 산화물의 상당 부분을 차지하여 그 경도를 향상시킨다.
구조
결정형 산화알루미늄의 가장 안정적인 구조는 코룬덤(Corundum)이다. 코룬덤은 Bravais lattice로는 hexagonal로 분류되나, rhomboheral 구조라 할 수 있다. Rhombohedral이란 모든 선분의 크기가 같고 선분간의 각도도 같지만 이 각도는 직각이 아닌 구조이다.
그림에 나타낸 것과 같이 O2- 가 hexagonal로 closed packing이 되어있고, 그 사이에 Al3+ 끼어들어간 구조라 볼 수 있다.
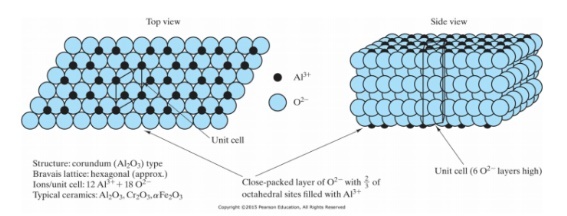
그림. corrundum의 구조(출처 : wikipedia.org)
그림과 같이 Top views에서, 2개가 배치되고 한 칸이 비는 형태로 Al3+원자가 들어간다. O2-은 2D lattice structure 중(Top view에서 보았을 때) area centered hexagon이며, Al3+은 parallelogram이다. top view에서 unit cell의 lattice point에 각각 Al3+이 위치해있는 데, 단 하나의 이온만 거기에 끼지 못하고 있다. 즉 unit cell 내에 있는 이온들의 수를 보면 한 층에 Al3+은 2개, O2-은 3개로 총 6개의 layers가 쌓여야 하나의 unit cell을 형성하여 Al3+ 12개, O2- 18개가 존재한다.
용도
2015년 전세계 연간 산화 알루미늄 생산량은 약 1억 1천 5백만 톤으로, 그 중 90% 이상이 알루미늄 금속 제조에 사용되었다.
특수 알루미늄 산화물의 주요 용도는 내화재, 도자기, 광택 및 연마재 용도에 있다. 알루미나가 파생된 알루미늄 수산화물의 큰 톤은 제올라이트, 티타니아 색소 코팅 및 화재 지연제/연기 억제제 제조에 사용된다.
알루미늄 금속 제조 외에 산화 알루미늄 용도는 다음과 같다.
필러 : 산화알루미늄은 화학적으로 안정하며 흰색이기 때문에 플라스틱을 위해 선호되는 필러로, 자외선 차단제의 주된 성분으로 블러셔, 립스틱, 매니큐어 등 화장품에도 사용된다.
유리 : 산화나트륨, 리튬산화물, 규소 등과 함께 유리의 주된 구성요소이다.
촉매 : 탈황화 및 지글러-나타 중합화와 같은 많은 산업 촉매의 촉매제 역할을 한다.
연마재 : 산화 알루미늄은 경도와 강도가 높고, 산업용 다이아몬드보다 저렴하여, 연마재로 널리 쓰인다. 산화알루미늄 결정은 절삭 공구, 사포 등에 널리 사용된다. 당구에 사용되는 “초크”, CD/DVD 광택 및 스크래치 수리 등에 산화알루미늄 분말이 사용된다.
도자기 : 내열 도자기, 도가니 등에 광범위하게 사용된다. 실리카와 일정비율 섞인 것을 뮬라이트(mullite)라고 하기도 한다.
그 외 도료, 합성섬유, 방탄복 등에도 사용된다.
'일반기술, 자연과학, 세라믹' 카테고리의 다른 글
산화마그네슘, 과산화마그네슘 (0) 2023.03.06 시멘트의 구성광물 (0) 2023.03.06 산화주석 (Tin Oxide) (0) 2023.03.05 유리섬유(Glass Fiber) (0) 2023.03.05 강도(압축강도, 인장강도, 휨강도) (0) 2023.03.05